(広島大学) プレスリリース低酸素環境下乳がんの浸潤転移を促進する分子を発見 ― 進行乳がんの治療標的となる可能性 ―
プレスリリース
2020年3月12日(木) 広島大学 霞キャンパス![]()
【研究成果】
低酸素環境下乳がんの浸潤転移を促進する分子を発見
― 進行乳がんの治療標的となる可能性 ―
【本研究成果のポイント】
- ●
- 急速に増殖を続ける乳がんなどの固形がん内部は、酸素供給不足から低酸素環境になっている事が知られています。そのような低酸素環境にあるがん細胞は、抗がん剤や放射線などの治療に抵抗性を示し、がん患者の予後不良に関係する事が示されています。
- ●
- 低酸素環境において活性化して、がん細胞の遊走・浸潤を促進し、放射線抵抗性を促進する分子 GLIS1 を発見しました。
- ●
- GLIS1は多くの遺伝子をコントロールし、特にその中のWNT5A というがん細胞浸潤に関わる遺伝子発現量を増やすことにより、がんの浸潤を促進している事が明らかとなりました。
- ●
- データベース解析から、治療法の確立されていない進行乳がんにおいて、GLIS1発現量が高いがん患者の予後は不良である事が明らかとなりました。さらに、低酸素で働く他の転写因子などと比較して、ヒトの正常細胞におけるGLIS1発現量が明らかに少ないため、副作用の少ない治療標的となり得る可能性が示されました。
- ●
- 研究グループでは、今回の研究成果をもとに、低酸素がんの克服にむけたGLIS1の機能を調節する薬剤開発研究を計画しており、治療法の確定していない進行乳がんなどに対する治療法開発への応用が期待されます。
【概要】
広島大学原爆放射線医科学研究所 放射線災害医療開発研究分野の島本和美大学院生、谷本圭司講師、廣橋伸之教授、大学共同利用機関法人情報・システム研究機構データサイエンス共同利用基盤施設ライフサイエンス統合データベースセンターの坊農秀雅特任准教授、小野浩雅特任助教、順天堂大学大学院 江口英孝准教授らの研究グループは、低酸素環境(※1)において活性化して、がん細胞の遊走・浸潤(※2)を促進し、放射線抵抗性を促進する分子GLIS1を発見しました。低酸素環境にあるがん細胞では、GLIS1量が増えて、様々な遺伝子発現量(※3)の調節を行うことが明らかとなり、特にWNT5Aというがん細胞の浸潤を促進することが知られている遺伝子を調節することにより、がん細胞の浸潤能力を高めていることを確認しました。また、遺伝子発現データベースとがん患者予後の解析ウェブツールKaplan-Meier Plotter(※4)により、乳がん患者の中でも、特にホルモン療法(※5)が効かない進行乳がん患者において、GLIS1発現量の高いがん患者の予後が明らかに悪いことが明らかとなり、実験的にもGLIS1量を減らすことにより、がん細胞の浸潤を抑制することに成功しました。さらに、正常組織における遺伝子発現の大規模測定データベースの比較ウェブツールRefEx(※6)にて、低酸素環境で働く他の転写因子(※7)に比べて、GLIS1は特に正常細胞における発現量が少ない事が明らかとなり、副作用の少ないがん治療標的となり得る可能性が示されました。
【背景】
酸素は生命機能の維持に必須であり、細胞には酸素欠乏(低酸素)に対応するための厳密な分子機構かが備わっています。高山病に代表される環境中の酸素低下のみならず、多くの疾患、例えば貧血、心臓や血管(循環器)の疾患、肺の疾患、糖尿病、がんなどで酸素供給不足による組織中の低酸素化かが疾患発症や増悪と関係することも分かってきました。
【研究内容】
研究グループでは、低酸素環境下ではどのような遺伝子が活性化(発現量が増加)され、どのような遺伝子が抑制(発現量が減少)されるのか、そして、それらは細胞の中でどのような働きをしているのか、様々な手法を用いて研究を進めてきました。
その中で、GLIS1という、iPS細胞の作製を効率よく高品質に進めることが示された分子に注目し、GLIS1が低酸素環境下で発現亢進すること、その詳細な分子機構を初めて明らかにして報告しましした。今回は、低酸素環境下で増加したGLIS1分子が、がん細胞の中でどのような働きをしているのか、低酸素環境下で増えたGLIS1を遺伝子レベルで人工的に減らしたり、人工的に増やしたりして調べました。その結果、 GLIS1はがん細胞の増殖を少し遅くする働きがあるようでしたが、明らかに、がん細胞の運動性や浸潤性を促進しました。さらに、GLIS1を人工的に増やしたがん細胞では、がんの浸潤に関わる遺伝子WNT5Aや放射線応答に関わる遺伝子CDKN1Aの発現量が増加し、細胞の浸潤能力を高めたり、放射線を照射しても死ににくくなったりしました。一方、GLIS1を人工的に抑制すると、浸潤能力が明らかに低下することも明らかになり、GLIS1の人工的な機能調節が治療に結びつく可能性を示しました。そして、遺伝子発現データベースとがん患者予後の解析ウェブツールKaplan-Meier Plotterにより、乳がん患者全体やホルモン受容体を持つ乳がん患者ではその差は見られないのに、ホルモン療法が効かない、ホルモン受容体を持たない進行乳がん患者において、GLIS1発現量の高い(GLIS1がよく働いている)がん患者の予後が明らかに悪い(生存期間が短い)ことが明らかとなりました。さらに、正常組織における遺伝子発現の大規模測定データベースの比較ウェブツールRefExにて、低酸素環境で働く他の転写因子HIF-1などに比べて、GLIS1は特に正常細胞における発現量が少ない事が明らかとなり、副作用の少ない(GLIS1の人工的な抑制を行なっても正常細胞 に影響が少ない)がん治療標的となり得る可能性が示されました。
【今後の展開】
今回、低酸素環境下の乳がん細胞において働く分子GLIS1 が、乳がんの浸潤・転移や、放射線などの治療抵抗性獲得に関わり、特に進行乳がんにおいて、治療標的となり得るという結果を得ました。今後、GLIS1機能(量)を人工的に抑制する方法(核酸医薬、既存・新規の薬や化合物)の開発をめざします。また、さらなるGLIS1機能の詳細を明らかにすることにより、GLIS1を人工的に抑制したときの副反応の予測が可能となります。
この研究成果は、放射線医学関連で最も権威のある北米放射線学会誌「Radiology」に掲載されました。
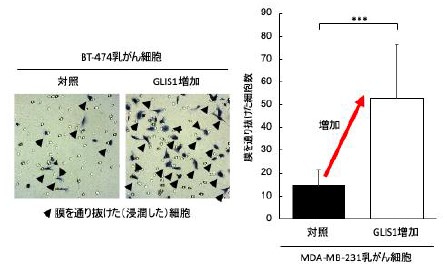
(図1) GLIS遺伝子発現増強によるがん細胞浸潤能の促進
GLIS1 を人工的に増やした乳がん細胞は、より多くの細胞が特殊な膜を通過し、浸潤していた(青く染まった矢印で示した細胞)。GLIS1量が増えることは、がんの潤転移を促進することが明らかとなりました。
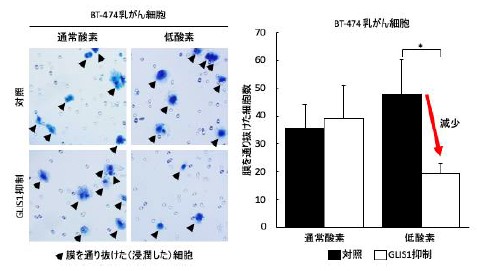
(図2) GLIS1遺伝子発現抑制によるがん細胞浸潤の抑制
GLIS1 量が増えることは、がんの浸潤転移を促進することが明らかとなったので、その増加を人工的に抑制した。その結果、通常の酸素環境では差が観察されなかったが、低酸素がん細胞では、GLIS1を抑制すると、特殊な幕を通過し、浸潤する細胞が減少した(青く染まった矢印で示した細胞)。すなわち、乳がん細胞のGLIS1を、薬などを用いて抑制する事が、がんの浸潤転移を抑制する可能性が示されました。
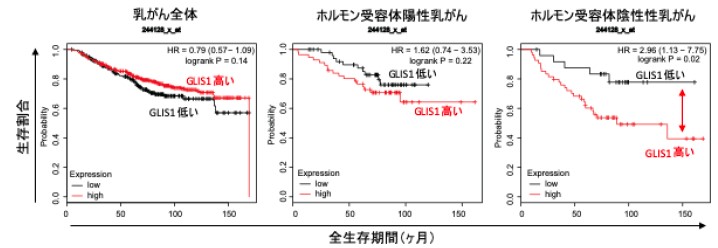
(図3) GLIS1 遺伝子発現量の相違による乳がん患者予後(生存率)の違い
遺伝子発現データベースとがん患者予後の解析ウェブツールKaplan-Meier Plotterにより、GLIS1発現量ががん患者予後にどのように影響しているか解析したところ、乳がん全体(左図)、ホルモン受容体陽性乳がん(中央)では、GLIS1 遺伝子発現量が高くても低くても、患者予後(生存率)に変化は認められなかったが、より進行したホルモン受容体陰性乳がん患者において、GLIS1遺伝子発現量が高い患者は低い患者に比べて、予後不良(生存率が低下)である事が明らかとなりました。
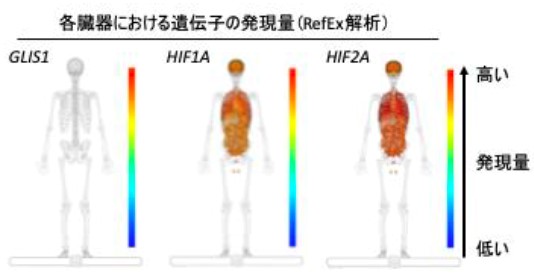
(図4) ヒト正常組織における、低酸素環境で働く転写因子遺伝子発現分布
正常組織における遺伝子発現の大規模測定データベースの比較ウェブツールRefEx にて、低酸素環境で働く転写因子HIF1AやHIF2Aなどに比べて、GLIS1は特に正常細胞における発現量が少ない事が明らかとなり、副作用の少ない(GLIS1の人工的な抑制を行なっても正常細胞に影響が少ない)がん治療標的となり得る可能性が示されました。
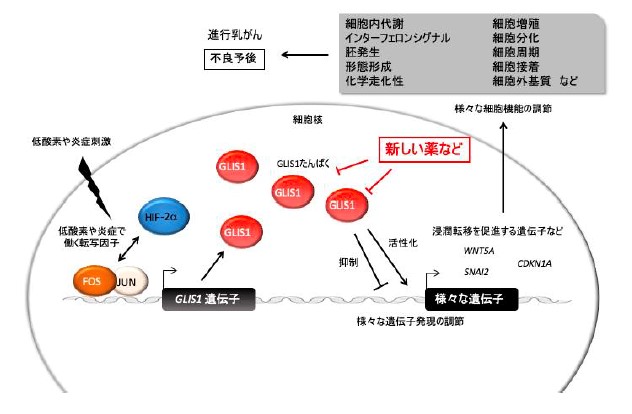
(図5) ヒト正常組織における、低酸素環境で働く転写因子遺伝子発現分布
以前、低酸素環境や炎症反応などにより、GLIS1遺伝子発現量が増加する機構を報告しました。今回、低酸素環境下の乳がん細胞において働く分子GLIS1が、様々な遺伝子の発現量の調節を行うことにより、乳がんの浸潤・転移や、放射線などの治療抵抗性獲得に関わり、特に進行乳がんにおいて、治療標的となり得るという結果を得ました。今後、GLIS1機能(量)を人工的に抑制する方法(核酸医薬、既存・新規の薬や化合物)により、進行乳がんの予後改善が見込まれます。
【論文情報】
- 掲載誌 :
- Carcinogenesis (DOI:10.1093/carcin/bgaa010)
- 論文タイトル :
- GLIS1, a novel hypoxia-inducible transcription factor, promotes breast cancer cell motility via activation of WNT5A.
- 著者名 :
- Kazumi Shimamoto, Keiji Tanimoto*, Takahiro Fukazawa, Hideaki Nakamura, Akinori Kanai, Hidemasa Bono,Hiromasa Ono, Hidetaka Eguchi, Nobuyuki Hirohashi * Corresponding author(責任著者)
